Content
La calor específica, la calor sensible i la calor latent són magnituds físiques:
el calor específica d'una substància és la quantitat de calor que cal subministrar a una unitat de massa d'aquesta substància per elevar la seva temperatura en una unitat. Aquesta quantitat varia tant depenent de la temperatura en què es troba la substància abans d'aplicar-li la calor. Per exemple, cal una caloria per augmentar en un grau l'aigua a temperatura ambient, però és necessària només 0,5 caloria per augmentar en un grau la temperatura de el gel a -5 graus. La calor específica també depèn de la pressió atmosfèrica. La mateixa substància a una pressió atmosfèrica menor té un menor calor específica. Els exemples que apareixen a continuació són vàlids per a una temperatura de 25 graus i una pressió d'1 atmosfera.
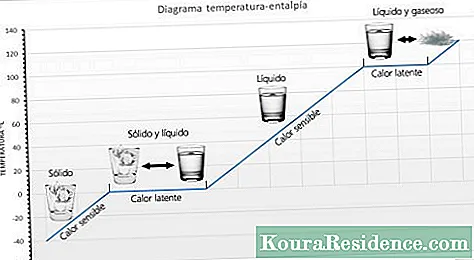
el calor sensible és la quantitat de calor que pot rebre un cos sense que afecti la seva estructura molecular. Si no canvia l'estructura molecular no canvia l'estat (sòlid, líquid, gasós). Atès que no canvia l'estructura molecular, s'observa un canvi de temperatura, per això s'anomena calor sensible.
el calor latent és l'energia (calor) necessari perquè una substància canviï de fase (estat). Si el canvi és de sòlid a líquid s'anomena calor de fusió. Si el canvi és de líquid a gasós s'anomena calor de vaporització. Quan se li aplica calor a una substància que ha arribat a la temperatura en què canvia d'estat, és impossible que augmenti la temperatura, sinó que simplement canvia d'estat. Per exemple, si es continua aplicant calor a l'aigua en ebullició, la mateixa no ha de sobrepassar mai els 100 ° C. Depenent de la substància, la calor latent pot mesurar-se habitualment en calories per gram o en kilojoules per quilogram (KJ).
Exemples de calor específica
- Aigua (en estat líquid): 1 Caloria per gram per augmentar 1ºC
- Alumini: 0215 caloria per gram
- Beril·li: 0436 caloria per gram
- Cadmi: 0.055 caloria per gram
- Coure. 0,0924 caloria per gram
- Glicerina: 0.58 caloria per gram
- Or: 0,0308 caloria per gram
- Ferro: 0.107 caloria per gram
- Plom: 0,0305 caloria per gram
- Silici: 0.168 caloria per gram
- Plata: 0.056 caloria per gram
- Potassi: 0.019 caloria per gram
- Toluè: 0.380 caloria per gram
- Vidre: 0.2 caloria per gram
- Marbre: 0.21 caloria per gram
- Fusta: 0.41 caloria per gram
- Alcohol etílic: 0.58 caloria per gram
- Mercuri: 0.033 caloria per gram
- Oli d'oliva: 0.47 caloria per gram
- Arena: 0.2 caloria per gram
Exemples de calor sensible
- Aplicar calor a l'aigua que es trobi entre 1 i 100 ° C
- Aplicar calor a estany que es trobi a menys de 240 ° C
- Aplicar calor a plom que es trobi a menys de 340 ° C
- Aplicar calor a zinq que es trobi a menys de 420 ° C
- Aplicar calor a alumini que es trobi a menys de 620 ° C
- Aplicar calor a bronze que es trobi a menys de 880 ° C
- Aplicar calor a níquel que es trobi a menys de 1450 ° C
Exemples de calor latent
Aigua: calor latent de fusió: 80 calories per gram (són necessàries 80 calories perquè un gram de gel a 0 ° C es converteixi en aigua), calor latent de vaporització: 540 calories per gram (són necessàries 540 calories perquè un gram d'aigua a 100 ° C es converteixi en vapor).
Acer: calor latent de fusió: 50 calories
Alumini: calor latent de fusió: 85 calories / 322-394 KJ; calor latent de vaporització: 2300 KJ.
Sofre: calor latent de fusió: 38 KJ; calor latent de vaporització: 326 KJ.
Cobalt: calor latent de fusió: 243 KJ
Coure: calor latent de fusió: 43 calories; calor latent de vaporització: 2360 KJ.
Estany: calor latent de fusió: 14 calories / 113 KJ
Fenol: calor latent de fusió: 109 KJ
Ferro: calor latent de fusió: 293 KJ; calor latent de vaporització: 2360 KJ.
Magnesi: calor latent de fusió: 72 calories
Mercuri: calor latent de fusió: 11.73 KJ; calor latent de vaporització: 356.7 KJ.
Niquel: calor latent de fusió: 58 calories
Plata: calor latent de fusió: 109 KJ
Plom: calor latent de fusió: 6 calories; calor latent de vaporització: 870 KJ.
Oxigen: calor latent de fusió: 3.3 calories
Or: calor latent de fusió: 67 KJ
Zinc: calor latent de fusió: 28 calories